10月11日から3日間に渡り東京国際フォーラムで第81回日本血液学会学術集会が開催されました。今回のテーマは「The Future is Now」。このテーマに合わせ本集会のメインビジュアルには「夢」の一文字が大きく描かれていました。残念ながら台風19号の影響で日曜日の演題は全て中止となりましたが、今年は国内初のCAR-T細胞療法が承認されるなど血液がん治療におけるさらなる進展が見えた年であり、CAR-T細胞療法については本集会でも様々なお話を聞くことができました。今後のさらなる展開に期待が膨らむ血液がん領域について本集会から注目すべきトピックをお届けします。
Topics:
- ついに日本でも承認されたCAR-T細胞療法
- Kymriahを治療経験医師はどう評価する?
- CAR-T細胞療法の普及の鍵は 『off-the-shelf』
- CAR-T細胞療法難治性と次世代CAR-T細胞療法の開発
- 求められる万全の副作用管理体制
- 固形がん応用への期待
ついに日本でも承認されたCAR-T細胞療法
2019年3月、国内では初となるCAR-T細胞療法「Kymriah」が、再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病(ALL)および再発又は難治性のCD19 陽性のびまん性大細胞型B細胞リンパ腫(DLBCL)を対象に承認されました。また5月には1患者あたりの治療費が3300万円と薬価基準上、過去最高の薬価が付けられた事でも注目を集めました。今回の日本血液学会学術集会では、Kymriahをはじめ、CAR-T細胞療法の現状、今後の展開について多く議論されていました。
Kymriahを治療経験医師はどう評価する?
KymriahのORR(寛解導入率)は、再発・難治性の急性リンパ芽球性白血病(ALL)で約80%(ELIANA試験)、再発又は難治性のびまん性大細胞型B細胞リンパ腫(DLBCL)で約50%(JULIET試験)と報告されており、実臨床でも年齢に関わらず、再発・難治性群に対する効果としては非常に高いORRが得られているとの事です。またDLBCLを対象としたJULIET試験の例となりますが、従来の抗がん剤の12か月後生存率約25%に対し、Kymriahは約50%を上回る点、実臨床でも大きな期待が寄せられていました。一方、北海道大学の豊嶋先生からは、Kymriahの治療効果を評価したうえで、スクリーニングからの投与実施率が低い点、投与できた患者における2年時点再発率が約4割である点、サイトカイン症候群など重篤な副作の発生頻度が高い事から、治療後の患者管理の重要性などいくつかの課題もあげられていました。
CAR-T細胞療法の普及の鍵は 『off-the-shelf』
Kymriahは患者自身の細胞(自家細胞)から製造する為、スクリーニングから投与までに約2か月の待機時間が発生してしまいます。1次治療後に非寛解であった患者、また高腫瘍度である患者への投与、十分な細胞が採取できないケース、また細胞が採取できた場合でも十分な細胞数まで製造できないケースなどの課題が残されているようです。この待機時間の改善、安定した製造ラインの確立の解決策として注目されるのが他家細胞やiPS細胞由来の‘off-the-shelf CAR-T’細胞療法です。高額となる細胞療法の治療費もより安価に汎用性の高いCAR-T細胞療法が実現できるのではと注目されていました。日本では小野薬品工業が他家CAR-T細胞 NKR-2の開発でセリアド社、iPS細胞由来他家CAR-T細胞療法の開発でFate Therapeutics社と提携。武田薬品工業はと京都大学iPS細胞研究所(CiRA)とiPS細胞由来CAR-T細胞療法の共同研究を開始しています。ドナー細胞における倫理的課題は引き続き残されていますが、今後のCAR-T細胞療法の普及には、この‘off-the-shelf’細胞が重要な役割を担うことになりそうです。
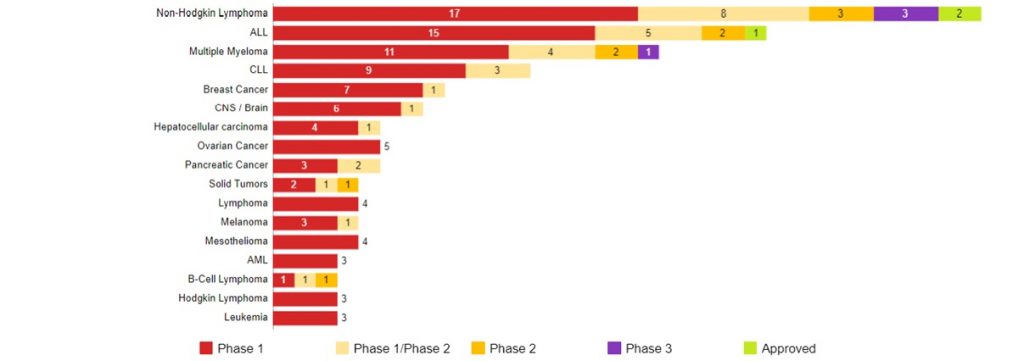
CAR-T細胞療法の開発動向 (がん種別 / 標的別) (米国)
Data Source : CancerLandscape (2019年10月現在) 開発上位一部
『CAR-T細胞療法難治性』と『次世代CAR-T細胞療法』の開発
10月11日から3日間に渡り東京国際フォーラムで第81回日本血液学会学術集会が開催されました。今回のテーマは「The Future is Now」。このテーマに合わせ本集会のメインビジュアルには「夢」の一文字が大きく描かれていました。残念ながら台風19号の影響で日曜日の演題は全て中止となりましたが、今年は国内初のCAR-T細胞療法が承認されるなど血液がん治療におけるさらなる進展が見えた年であり、CAR-T細胞療法については本集会でも様々なお話を聞くことができました。今後のさらなる展開に期待が膨らむ血液がん領域について本集会から注目すべきトピックをお届けします。
求められる万全の副作用管理体制
Kymriahで最も高頻度に発生する副作用はサイトカイン放出症候群(CRS)で、ALLを対象としたELIANA試験では、Kymriah投与患者の77%でCRSが報告され、重篤なCRSは63%と高い頻度で発生する事が報告されています。CAR-T細胞は投与後に体内で増殖し、患者によってその増殖傾向が異なります。CAR-T細胞が急激に増加する患者群ではサイトカインが大量に産生され、重篤なサイトカイン放出症候群になってしまうとの事です。どのような副作用が発生するかは予め把握できたとしても、どの程度の強さで発生するかは現状把握できないようです。日本ではKymriahをはじめCAR-T細胞療法における製造販売後の全例調査データは日本造血細胞移植データセンター(JDCHCT)にて収集される事となっており、国際間データシェアリングの環境整備についても検討が進んでいるようです。
固形がん応用への期待
現在承認されているCAR-T細胞療法は、血液がんで多くみられるCD19抗原を標的としており、白血病やリンパ腫が対象となります。また開発中の多くも血液がんを対象としており、固形がんにおけるCAR-T細胞療法の開発は限定的です。CAR-T細胞に付ける適切な抗原が見つかっていない、CAR-T細胞を局所に送り届ける事が困難であるなどの背景がある様です。
そんな中、山口大大学院医学系研究科免疫学講座の玉田先生から、基礎研究における免疫機能調整型次世代キメラ抗原受容体発現T細胞「Prime CAR-T細胞」についてお話がありました。このPrime CAR-T細胞は、T細胞の長期生存、集積の誘導に関与するIL-7というサイトカインとCCL19というケモカインの両方を産生するようにデザインされたCAR-T細胞です。in vitro において従来のCAR-T細胞と比較し長期生存、周囲に存在するT細胞などの集積を誘導する能力が確認されています。また固形がんマウスモデルを用いた基礎研究では、従来のCAR-T細胞投与ではほとんど治療効果が認められなかったのに対し、Prime CAR-T細胞を投与したマウスでは腫瘍局所でリンパ球浸潤が認められ、がんの増殖が抑制されている事が確認されています。このPrime CAR-T細胞療法については、武田薬品とノイルイミューン・バイオテック社が共同研究を進めており、年内にも臨床試験が開始される予定との事です。
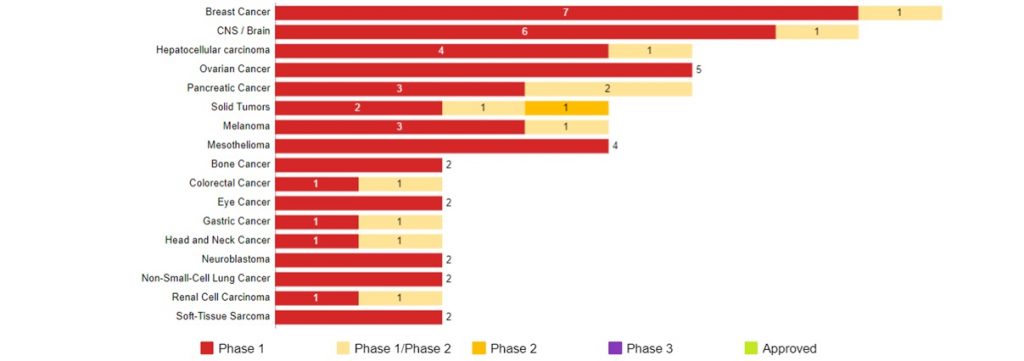
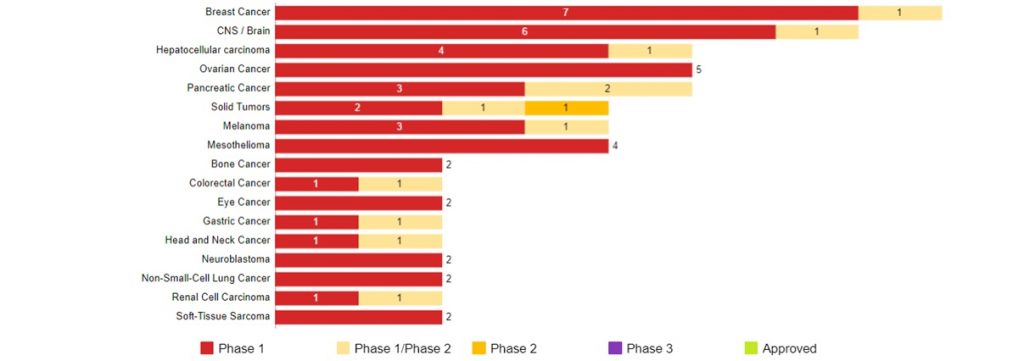
固形がんを対象としたCAR-T細胞療法の開発動向 (米国)
Data Source : CancerLandscape (2019年10月現在) 開発上位一部
国内ではKymriahに続き、第一三共のYescarta(axicabtagene ciloleucel)が年内に承認申請を予定しています。さらに、次世代CAR-T細胞療法の開発も続々と進み、より汎用性が高くより多くのがん種での治療の可能性に期待が高まります。しかし一方で、CAR-T細胞療法は高い有効性を示すものの、今回ご紹介した副作用や再発、投与実施率等の課題をふまえると実際の治療においては患者選定が今後さらに重要となりそうです。
